检验检测机构管理体系文件思维导图和编制方法
作者:而立居士发布时间:2022-05-30分类:检测管理浏览:1466评论:0
不管是第一方实验室、还是第三方实验室、建立的质量管理体系均需要“满足认可准则和/或资质认定条款的要求、组织架构明晰、岗位职责和能力要求合理、文件间的逻辑关系清晰”,因此将实验室管理体系的建立问题进行总结就变得尤为重要。
实验室任何和资质认定的过程比较繁杂,在实际的建立过程中,我们经常会碰到各种问题,趟过的坑儿必然也不少。因此,整理了如下的内容,供朋友们参考。
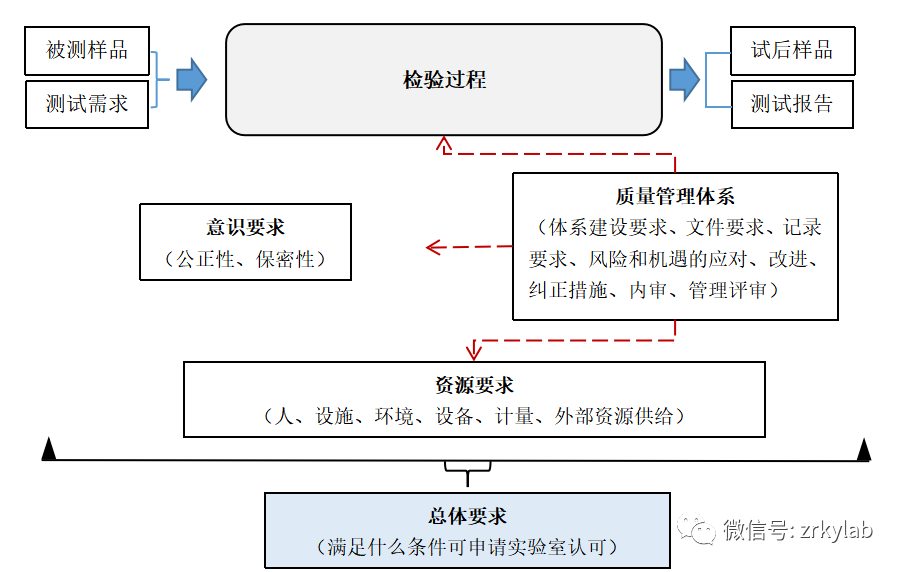
图1 CNAS/CMA整体要求的逻辑
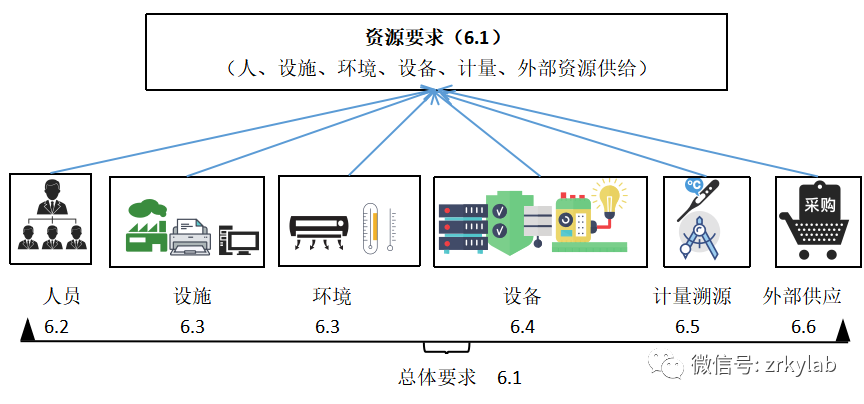
图2 资源要求的逻辑
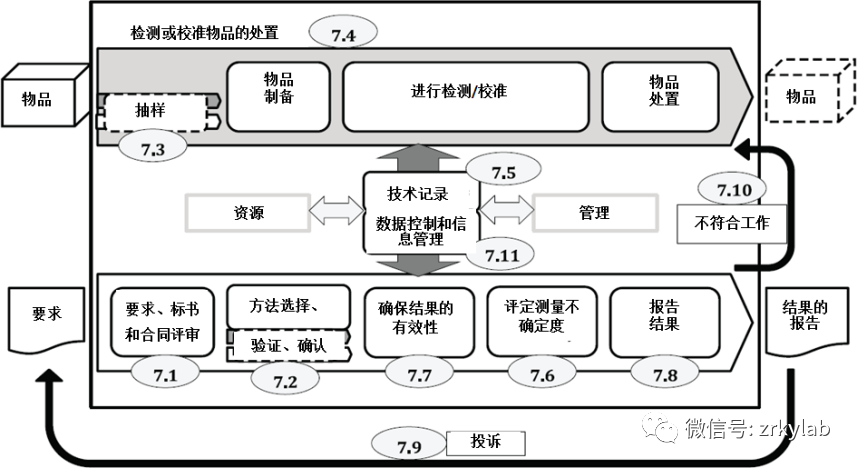
图3 检验过程要求的逻辑
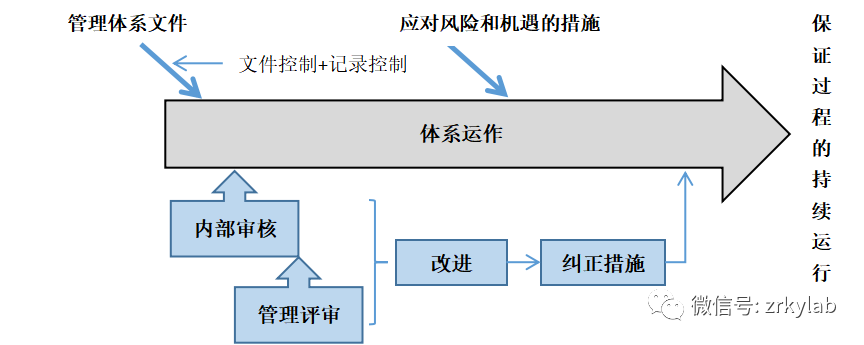
图4 管理体系要求的逻辑
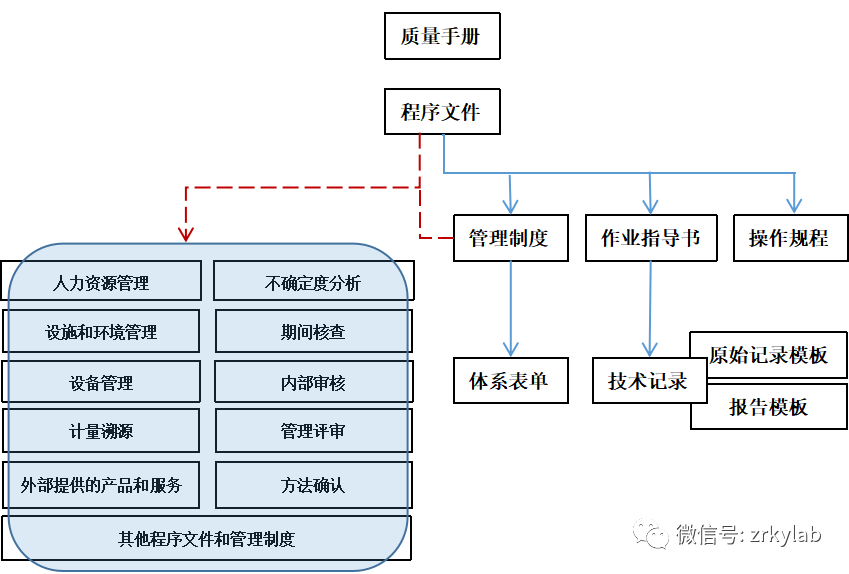
图5 文件逻辑示意图

体系要素 | 需要的表单 |
人力资源 | |
设备管理 | |
计量溯源 | 测量设备汇总表、校准方案、校准计划、校准证书、校准结果确认表 |
文件管理 | |
合格供方 | 合格供方目录、合格供方评价表(含再评价) |
检验过程 | |
质量监督 | 质量监督计划、质量监督记录 |
质量监控 | 质量监控计划、质量监控记录 |
期间核查 | 期间核查记录 |
数据控制 | 软件功能确认表、软件汇总表 |
环境确认 | |
安全管理 | 检测环境监控记录表、实验室安全检查表、废弃物处理登记表 |
标准物质 | 标准物质台账、标准物质领用记录、标准物质购买记录、标准物质期间检查记录 |
保密性 | 客户来访登记表、员工入职承诺书、保秘性检查记录表、员工离职保密协议 |
分包 | 分包协议、分包评审表、分包实验室目录、分包交接记录、分包工作登记表 |
公正性 | 公正性承诺书、公正性检查记录表 |
标准查新 | 标准查新记录、标准清单 |
能力验证 | 能力验证计划、能力验证汇总表、能力验证记录 |
方法确认 | |
质量目标 | 质量目标分解表、质量目标汇总表 |
顾客满意度 | 顾客满意度调查表、顾客满意度汇总分析表 |
内外部环境分析 | 公司环境分析报告、风险和机遇评估分析表 |
风险分析 | 风险和机遇评估分析表、风险记录表 |
内部审核 | 内审计划、内审方案、内审检查表、首次会议签到表、末次会议签到表、内审报告 |
管理评审 | 管理评审输入表、管理评审签到表、管理评审报告 |
归档 | 报告归档登记表、报告司印登记表、电子文件台账 |
(4)CNAS-CL01-AXXX:20XX《检测和校准实验室能力认可准则在XXX领域的应用说明》特别强调1:在做CNAS之前,一定要搞清楚检测类别是哪一类,选择第4个应用说明依据必须依据被检测对象来确定,比如A002为化学检测、A003为电气检测、A008为电磁兼容检测;★特别强调2:每次编制文件之前,请确认依据文件的版本号,比如2018、2019、2020等,请注意文件版本的发布日期、质量手册编制日期与引用文件发布日期的逻辑关系。★特别强调3:查询网站https://www.cnas.org.cn/rkgf/sysrk/rkyyzz/index.shtml请定期查询引用文件的名称及版本号
【依据CL01认可准则+G001<认可准则>应用要求+AXXX《在XXX领域的应用说明》的要求编写】
【编写格式一般如下】
4.1 公正性 [对应CL01的条款号及条款名称]
4.1.1目的 [本条款的编写目的]
4.1.2范围 [本条款的适用范围]
4.1.3职责 [与本条款有关的人员职责]
4.1.4要求:实验室建立了涉及以下活动的《XXXXX程序》和《监督管理程序》并保留相关记录。
★特别强调:每个条款内容与CL01的内容基本一致,其中第一条之前写上这一句话。
4.1.4.1 XXXXXX
4.4.4.2 XXXXXX
★特别强调:如果有些条款有G001和类似A003的附加要求,一般是在相应的条款中增加想对应的内容,如果对应的要素比较复杂,请增加如下内容进行补充。[CNAS-CL01-AXXX:20XX]第XXX条的附件要求:XXXXXXXX[与CNAS-CL01-AXXX:20XX第XX条的内容一致]
★特别强调:在编写要求的内容时,由于引用的是CL01等准则及应用说明的条款,请将出现的“应”修改为“要求”。
4.1.5 支持性文件
XXXX 《XXXX程序文件》
★特别强调:所有出现该程序文件编号和名称的地方均需要保持一致。【示 例】
★重点关注[表单式样:页眉页脚、标识logo、编页、字体、间距等信息]
本篇文章来源于微信公众号: 检验检测机构实验室技术交流
相关推荐
- 水利工程检测专业问答指南:20个高频问题全解析
- 山东2025年度三十一批的工程质量检测机构资质审查汇总结果出炉!400+机构通关,行业格局迎新变化
- 山东2026首批建设工程质量检测机构资质审查结果出炉!12家企业命运分化,行业洗牌信号明显
- 一次讲清!建筑材料及构配件、主体结构及装饰装修、钢结构、地基基础专项最常问的若干个问题
- 不踩评审红线!实验室体系运行必备记录全梳理
- 人员监督、人员能力监控的9个典型问题
- 检验检测机构十大领域125项常见问题清单,务必逐条自查!
- 关于开展2025年资质认定检验检测机构能力验证工作的通知
- 权威发布 | 山东再添生力军!2025年度第七批6家建设工程质量检测机构资质名单出炉
- 建设工程质量检测机构资质延期政策解析:平衡监管与行业发展的挑战
欢迎 你 发表评论:
- 检测管理排行
- 公益广告(请勿拦截)
-
- 最近发表
-
- 山东2026年度建设工程质量检测机构资质通过名单(汇总1批,含公示)
- 外墙外保温工程中,锚栓数量到底打多少个?
- 关于GB/T 50082-2024《混凝土长期性能和耐久性能试验方法标准》国家标准勘误的说明
- 新国标执行!照明与配电节能工程进场复验,这5项缺一不可(后附复验汇总表)
- 植筋拉拔检测怎么做?3%还是1%?一文看懂抽检比例与时间
- 水利工程检测专业问答指南:20个高频问题全解析
- 山东2025年度三十一批的工程质量检测机构资质审查汇总结果出炉!400+机构通关,行业格局迎新变化
- 山东2026首批建设工程质量检测机构资质审查结果出炉!12家企业命运分化,行业洗牌信号明显
- 水利工程质量检测员资格考试大纲
- 《标准物质管理办法》出台
- 信息统计
-
- 文章总数:1593
- 页面总数:10
- 分类总数:44
- 标签总数:11
- 评论总数:179
- 浏览总数:2274829





 微信扫一扫,打赏作者吧~
微信扫一扫,打赏作者吧~











